CONFIGURACIÓN ELECTRÓNICA
CONFIGURACIÓN ELECTRÓNICA
Para comenzar atentos la siguiente aplicación:
INTRODUCCIÓN
Electrón
El electrón es una partícula elemental, extranuclear, cuya masa en reposo es 9,1 × 10 – 28 [ g ]. Posee carga eléctrica negativa de magnitud – 1,6 × 10 – 19 [ C ] , igual a la del protón, pero de signo contrario. Por esto el átomo eléctricamente neutro posee el mismo número de protones y electrones.
Orbital
Cada orbital describe la distribución de densidad de carga alrededor del núcleo y es caracterizado por tres números cuánticos: n , l y m .
Número cuántico principal ( n )
El número cuántico principal de un electrón es un entero positivo y da una medida de su energía en un orbital dado. A medida que aumenta el valor de n, también aumenta el valor de la energía.
n = 1 , 2 , 3 , 4 , 5 , . . .
Número cuántico secundario ( l )
El número cuántico secundario es un entero no negativo menor o igual a n:
l = 0 , 1 , 2 , . . . , n – 1
Este número da una medida del momento angular clásico del electrón.
Cada valor de l está asociado a una forma orbital simbolizada por una letra minúscula.
Ejemplo:
l = 0 , orbital s
l = 1 , orbital p
l = 2 , orbital d
Cada orbital se simboliza con un número y una letra minúscula, donde el número es el valor de n y la letra minúscula indica el de l .
Ejemplos:
n = 1 Þ l = 0 orbital 1s
n = 2 Þ l = 0 , 1 orbitales 2 s y 2 p
n = 3 Þ l = 0 , 1 , 2 orbitales 3 s , 3 p y 3 d
n = 4 Þ l = 0 , 1 , 2 , 3 orbitales 4 s , 4 p , 4 d y 4 f
Número cuántico magnético ( m ) ( m l )
El número cuántico magnético es un entero mayor o igual a – l y menor o igual a l .
Ejemplos:
l = 0 Þ m = 0
l = 1 Þ m = – 1 , 0 , 1
l = 2 Þ m = – 2 , – 1 , 0 , 1 , 2
El número de valores que puede tomar m para cada valor de l , indica el máximo número de orbitales de ese tipo, para cada valor de n .
Ejemplos:
l = 0 Þ m = 0 Þ un orbital s
l = 1 Þ m = – 1 , 0 , 1 Þ tres orbitales p
l = 2 Þ m = – 2 , – 1 , 0 , 1 , 2 Þ cinco orbitales d
Observación: Para cada valor de n hay como máximo n 2 orbitales.
Ejemplo: Para n = 3 hay como máximo 9 orbitales.
Spin del electrón ( s ) ( m s )
Este cuarto y ultimo número cuántico toma solamente dos valores: –1 / 2 y +1 / 2 .
Según el modelo clásico se asocia al sentido de giro del electrón.
PRINCIPIOS QUE RIGEN LA CONFIGURACIÓN ELECTRÓNICA
Llenado de orbitales
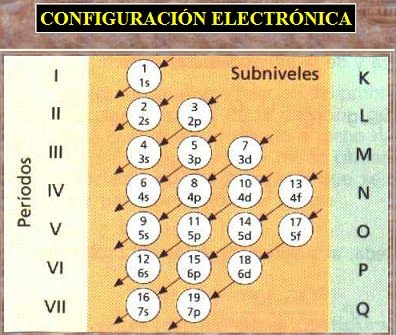
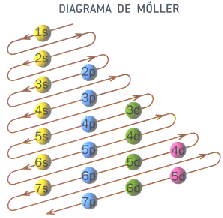
El orden de “llenado” de orbitales , para los primeros 36 elementos, del Hidrógeno ( Z = 1 ) al Kriptón ( Z = 36 ) es:
1 s , 2 s , 2 p , 3 s , 3 p , 4 s , 3 d y 4 p
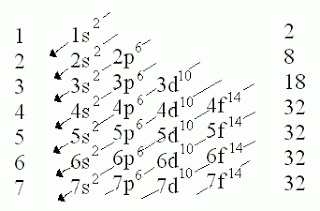
Ejemplos:
Z = 6 Carbono C: 1 s 2 2 s 2 2 p 2
Z = 17 Cloro Cl: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 5
Z = 20 Calcio Ca: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2
Z = 26 Hierro Fe: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 6 4 s 2
Z = 35 Bromo Br: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 5
Solamente hay dos excepciones:
Z = 24 Cromo Cr: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 5 4 s 1
Z = 29 Cobre Cu: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 1
Este orden de “llenado” se debe a que la distribución en orbitales de los electrones de un átomo, está regida por los siguientes principios:
Principio de exclusión ( Pauli )
Dos o más electrones de un mismo átomo no pueden tener el mismo conjunto de números cuánticos.
De acuerdo con esto, cada orbital está formado por uno o dos electrones como máximo, porque un tercer electrón coincidiría en su valor de spin con alguno de los otros dos.
Ejemplo:
En la configuración electrónica del Litio: 1 s 2 2 s 1 , el tercer electrón ocupa el segundo orbital.
Observación: Para cada valor de n hay como máximo 2 n 2 electrones.
Principio de máxima multiplicidad ( Regla de Hund )
Si dos o más electrones de un mismo átomo tienen los mismos valores en sus números cuánticos principales ( n ) y en sus números cuánticos secundarios ( l ) , entonces tendrán iguales valores de spin ( s ) siempre y cuando no se transgreda el principio de exclusión.
Ejemplo:
En la configuración del Nitrógeno: 1 s 2 2 s 2 2 p 3 , los electrones en los tres orbitales 2 p tienen igual valor de spin.
Para comprenerlo mejor, usaremos los suiguientes simuladores:
Configuraciones electrónicas 1
Configuraciones electrónicas 2
VÍDEOS
En los vídeos siguientes hay ejemplos de configuración electrónica:
9 comentarios
Anónimo -
mondonguda -
jaja
anonimo -
maria viera correqa -
daniel -
Anónimo -
Rocío Sánchez Contioso -
Guillermo Calleja Cuevas -
Pablo RG -