LOS ÁTOMOS

De qué están formadas las cosas?
Todos nos hemso preguntado esta cuestión alguna vez, y hemos dicho, pues de moléculas, atomos..., pero... ¿Por qué no los vemos? pues pincha AQUI y lo verás.
Esta pregunta fue hecha por los científicos desde el siglo V a. C. Uno de los primeros que intentaron responderla fue el filósofo griego Demócrito, quien dijo que la materia estaba formada por partículas indivisibles muy pequeñas a las que llamó átomos (sin división).
En 1808, John Dalton, científico y profesor inglés, formuló una definición precisa acerca de la estructura de la materia. Esta primera teoría marca el inicio de la era moderna de la química. Sus ideas se pueden expresar del siguiente modo:
1. Los elementos están formados por partículas extremadamente pequeñas llamadas átomos. Todos los átomos de un elemento dado son idénticos en tamaño, masa y propiedades químicas. Los átomos de un elemento difieren de los átomos de todos los demás elementos.
2. Los compuestos están formados por átomos de más de un elemento. En cualquier compuesto, la relación entre el número de átomos de cualquier par de elementos presentes es un entero o una fracción simple.
3. Una reacción química implica sólo una separación, combinación o reordenamiento de átomos; éstos no se crean ni se destruyen.
Para visualizar esta teoría pulsa "Teoría tómica de dalton" y de forma genérica "Modelos atómicos"
Con esta teoría, Dalton no intentó describir la estructura o composición de los átomos; sin embargo, logró visualizar que, por ejemplo, las propiedades diferentes de los elementos hidrógeno y oxígeno se pueden explicar suponiendo que ambos átomos no son iguales. Por otra parte, intentó explicar cómo se unen estos elementos para formar un compuesto, señalando que se requiere un número correcto de átomos. Por ejemplo en la molécula de agua, H2O, se requieren dos átomos de hidrógeno y uno de oxígeno.
Ejercicio:
Clasifica en elementos, compuestos y mezclas: cloruro de sodio (NaCl); sacarosa o azúcar común; plata; agua azucarada; óxido de mercurio (II) (HgO); cobre; aire; y nitrato de potasio (KNO3).
Estructura del átomo
Luego de la formulación de la teoría de Dalton, a partir de 1850 comenzó una serie de investigaciones para determinar qué hay dentro de estas partículas indivisibles que conforman la materia. Las investigaciones dieron lugar al descubrimiento de tres partículas subatómicas: el electrón, el protón y el neutrón.
Electrones
Joseph Thompson realizó un experimento que le permitió descubrir pequeñas partículas con carga negativa a las que llamó electrones. Este experimento se realiza en un equipo de descarga eléctrica que consiste en una placa con carga positiva llamada ánodo, que atrae partículas con carga negativa (o electrones) emitidas por el cátodo (placa con carga negativa). El haz de electrones forma lo que los primeros investigadores llamaron rayo catódico. Este rayo viaja hasta incidir en la superficie interna del extremo opuesto del tubo. La superficie está recubierta con un material fluorescente, como sulfuro de zinc, de manera que se observa una intensa fluorescencia o emisión de luz cuando la superficie es bombardeada por los electrones. Para conocer la carga de los rayos catódicos, a este sistema se le agregó un imán para ver si estas partículas eran o no desviadas por el campo magnético del imán. Se observó que en presencia de este campo las partículas eran desviadas de su trayectoria; sin embargo, en ausencia del campo magnético las partículas siguen una trayectoria rectilínea hasta chocar con la superficie recubierta con material fluorescente.
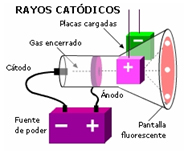
Figura 1: Esquema de un tubo de rayos catódicos de Thompson
Esto dió lugar al "Modelo atómico de Thompson", pinchalo para comprenderlo mejor. También puedes comprenderlo con "Modelo Atómicos" y verlo de forma animada
Lo anterior permitió establecer que la carga de los rayos catódicos o electrones es negativa e igual a -1.6 x 10-19C y su masa igual a 9.09 x 10-28 g.
A partir de este experimento Thompson imaginó el átomo como una esfera sólida con cargas positivas a la cual se insertan electrones en la superficie. De modo que cuando se aplica la suficiente energía, dichos electrones salen del átomo como rayos catódicos. Esto caracteriza al átomo como eléctricamente neutro.

Figura 2: Modelo atómico de Thompson
Protones
En 1910, Ernest Rutherford (quién estudió bajo la dirección de Thompson) decidió usar partículas a (o núcleos de helio) para probar la estructura de los átomos. Las partículas a son más grandes y pesadas que los electrones y tienen un equivalente a dos cargas positivas.
Rutherford efectuó una serie de experimentos en los cuales se utilizaron hojas delgadas de oro y otros metales como blancos de partículas a emitidas por una fuente radiactiva. Como resultado de estas pruebas observó tres trayectorias:
1. La mayoría de las partículas penetraba la hoja sin desviarse o con ligera desviación.
2. Algunas partículas a se desviaban atravesando la lámina.
3. Pocas partículas chocaban con la lámina regresando hacia su fuente de emisión.
Con esto, Rutherford dejó a un lado el modelo atómico planteado por Thompson para plantear uno nuevo "Modelo Atómico de Rutherfor". Según el "Modelo de Rutherford", la mayor parte de un átomo debe ser espacio vacío (para que las partículas alfa pasen a través de la lámina sin desviar su trayectoria). Las cargas positivas del átomo se encuentran todas concentradas en un punto central llamado núcleo, de modo que cuando las partículas a se acercan al núcleo son fuertemente desviadas por repulsión electroestática. Por último, si una partícula a viaja directamente hacia el núcleo experimenta una repulsión que invierte por completo el sentido de su movimiento y la hace regresar hasta su fuente de emisión.
A las partículas positivas que están dentro del núcleo se les llamó protones y tienen la misma cantidad de carga que un electrón, pero positiva. Más adelante se determinó que la masa de un protón es 1.672 x 10-24 g.
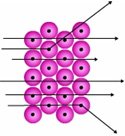
Figura 3: Trayectoria de partículas alfa (a) al atravesar una lámina de oro
Resumiendo, los científicos de la época percibían que la estructura del átomo consiste en un núcleo donde se concentra la mayor parte de la masa total del átomo, pero que ocupa un pequeño volumen de éste. Los átomos son eléctricamente neutros y concentran la carga positiva en el núcleo, mientras que las cargas negativas se encuentran alrededor de éste.
Neutrones
El siguiente problema referente a la estructura atómica se origina al comparar los dos átomos más pequeños que existen: el hidrógeno y helio. El hidrógeno tiene sólo un protón, mientras que el helio tiene dos protones. Por tanto, la relación de masas entre ambos debería ser 2:1; sin embargo, la relación es 4:1. Debido a esto, se supuso que en el interior del núcleo existía una tercera partícula, sin carga (para mantener la electroneutralidad del átomo). A esta partícula se le llamó neutrón, y su descubrimiento se le atribuye al científico James Chadwick. La masa de estas partículas es ligeramente mayor que la masa de los protones: 1.674 x 10-24 g.
Al modelo atómico que planteó Rutherford se le llamó modelo planetario del átomo, ya que propuso que los electrones giran en torno al núcleo en órbitas definidas, tal como lo hacen los planetas en torno al Sol.
18 comentarios
landysh -
¡GRACIAS!
Angel Gómez -
Pues la verdad es que leyendolo y viendo imagenes en movimiento , se entiende mejor que si lo vemos en un libro y quiere decir que dalton , dijo que eran indivisibles , thomson dijo decia que tenian protones y electrones y rutherford dijo que los protones estaban en el nucleo y los electrones giran alrededor.
Muchas Gracias
Enrique Cano -
Dalton dijo que todos los elementos estaban formados por átomos, y que era el elemento más pequeño.
Thomsom añadió que tenian electrones y protones
Rutherford descubrio que los electrones giran alrededor de los protones que se encuentran en el núcleo
Alejandro Crespo -
Aparte de esto, tambien nos cuenta que los protones estan en el nucleo de los atomos y que los electrones giraban alrededor de los protones
nerea -
Dalton dijo que los átomos eran indivisibles pero Thomson descubrio que los átomos tienen protones y neutrones y por último Rutherford descubrio que los protones estan en el núcleo del átomo y que los electrones giran a su alrededor
yanierkis Armario Aguirre -
Dalton descubrio que los elementos estaban formados por atomos(pero su teoria no era del todo cierta porque estos son divisibles)
Thomsonn,tras algunos experimentos descubrio los electrones
Rutherford descubrio que en un atomo el nucleo esta rodeado de vacio
Julián Sánchez -
Dalton creía que los atomos eran todos iguales e indivisibles. Luego Thompson descubrió los protones y los electrones, con lo que la teoria de Dalton quedaba desmentida. Despues Rutherford descubrió que los protones se situaban en el núcleo y que los electrones giraban a su alrededor.
Alba Roa -
Dalton pensaba que los átomos eran indivisibles, pero Thompson desmintió esa teoría descubriendo los protones y los electrones; Rutherford descubrió que los protones estaban situados en el núcleo del átomo y los electrones estaban situados a su alrededor girando.
Estefanía Muñoz -
Dalton creía que los átomos eran todos iguales e indestructibles. Thompson descubrió los electrones y los protones. Y Rustherford descubrió que los protones eran el núcleo (junto con los neutrones) y los electrones giraban alrededor como hacen los planetas con respecto al sol.
vicente fernandez -
dalton: dijo que la materia estaba formada por atomos indestructibles
thompson: dijo que el atomo esta formado por protones y electrones, y esto esta incrustados en los protones
rutherford: dijo que el atomo esta constituido por un nucleo donde estan los protones y los electrones giran alrededor
juan fernández moreno -
Dalton: descubrió que la materia esta compuesta por algo mas pequeño
Thompson: descubrió que había algo con carga negativa y los llamo electrones
Rutherfor: descubrió los protones y neutrones por el experimento de partículas alfa que atravesaban una lamina de oro.
Rocío Sánchez -
Primero Dalton , descubrió que la materia estaba formada de algo indivisible (átomos).
Después Thompson , descubrió a través de un experimento con los rayos catódicos , los electrones ; que son pequeñas partículas conn carga negativa.
Y por último , Rutherfor descubrió los protones ( carga positiva) y los neutrones ( carga neutra ) . Esto lo hizo gracias a un experimento con las partículas alfa las cuales atravesaban una lámina de oro. Con esto llegó a la conclusión de la masa del átomo se encuentra concentrada en un sitio y el resto esta hueco.
Manuel Romero -
La teoría de Dalton dice que logró visualizar que, por ejemplo, las propiedades diferentes de los elementos hidrógeno y oxígeno se pueden explicar suponiendo que ambos átomos no son iguales.
La teoría de Thompson dice que existe una carga negativa en el átomo y una positiva que es igual a la negativa.
La teoría de Rutherford dice que dice que el átomo tiene un núcleo que es donde esta la mayor parte del átomo.
María Marín Palanco -
Pablo RG -
Pablo Rodríguez González -
Guillermo Calleja Cuevas -
Por otro lado, os aconsejo que antes de publicar el comentario, realicéis una lectura para evitar faltas ortográficas.
juan fernandez -