NÚMERO ATÓMICO Y MASA ATÓMICA. ISÓTOPOS

Los átomos están formados por un núcleo (formado por protones y neutrones), de tamaño reducido y cargado positivamente, rodeado por una nube de electrones, que se encuentran en la corteza.
El número de protones que existen en el núcleo, es igual al número de electrones que lo rodean. Este número es un entero, que se denomina número atómico y se designa por la letra, "Z".
La suma del número de protones y neutrones en el núcleo se denomina número másico del átomo y se designa por la letra, "A".

El número de neutrones de un elemento químico se puede calcular como A-Z, es decir, como la diferencia entre el número másico y el número atómico.
Para comprenderlo "!PÍNCHAME!" y a contnuación realizaremos los siguientes ejercicios interactivos Ejercicio 1 y Construye átomos
No todos los átomos de un elemento dado tienen la misma masa. La mayoría de los elementos tiene dos ó más isótopos, átomos que tienen el mismo número atómico, pero diferente número másico. Por lo tanto la diferencia entre dos isótopos de un elemento es el número de neutrones en el núcleo. En un elemento natural, la abundancia relativa de sus isótopos en la naturaleza recibe el nombre de abundancia isotópica natural. La denominada masa atómica de un elemento es una media de las masas de sus isotópos naturales ponderada de acuerdo a su abundancia relativa.
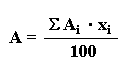 | A = masa atómica del elemento natural Ai = masa atómica de cada isótopo xi = porcentaje de cada isótopo en la mezcla |
La nube de carga electrónica constituye casi todo el volumen del átomo, pero, sólo representa una pequeña parte de su masa. Los electrones, particularmente la masa externa determinan la mayoría de las propiedades mecánicas, eléctricas, químicas, etc., de los átomos, y así, un conocimiento básico de estructura atómica es importante en el estudio básico de los materiales de ingeniería.
Veamos una serie de ejemplos
![]() Para el carbono Z=6. Es decir, todos los átomos de carbono tienen 6 protones y 6 electrones.
Para el carbono Z=6. Es decir, todos los átomos de carbono tienen 6 protones y 6 electrones.
El carbono tiene dos isótopos: uno con A=12, con 6 neutrones y otro con número másico 13 (7 neutrones), que se representan como:
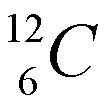
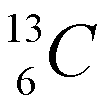
El carbono con número másico 12 es el más común (~99% de todo el carbono). Al otro isótopo se le denomina carbono-13.
![]() El hidrógeno presenta tres isótopos, y en este caso particular cada uno tiene un nombre diferente
El hidrógeno presenta tres isótopos, y en este caso particular cada uno tiene un nombre diferente
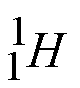
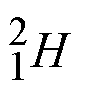
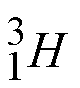
hidrógeno deuterio tritio
La forma más común es el hidrógeno, que es el único átomo que no tiene neutrones en su núcleo.
![]() Otro ejemplo son los dos isótopos más comunes del uranio:
Otro ejemplo son los dos isótopos más comunes del uranio:
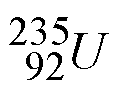
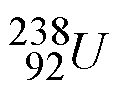
los cuales se denominan uranio-235 y uranio-238.
En general las propiedades químicas de un elemento están determinadas fundamentalmente por los protones y electrones de sus átomos y en condiciones normales los neutrones no participan en los cambios químicos. Por ello los isótopos de un elemento tendrán un comportamiento químico similar, formarán el mismo tipo de compuestos y reaccionarán de manera semejante.
Masa atómica
La masa atómica relativa de un elemento, es la masa en gramos de 6.02 ·1023 átomos (número de Avogadro, NA) de ese elemento, la masa relativa de los elementos de la tabla periódica desde el 1 hasta el 105 esta situada en la parte inferior de los símbolos de dichos elementos. El átomo de carbono, con 6 protones y 6 neutrones, es el átomo de carbono 12 y es la masa de referencia para las masas atómicas. Una unidad de masa atómica (u.m.a), se define exactamente como 1/12 de la masa de un átomo de carbono que tiene una masa 12 u.m.a. una masa atómica relativa molar de carbono 12 tiene una masa de 12 g en esta escala. Un mol gramo (abreviado, mol) de un elemento se define como el numero en gramos de ese elemento igual al número que expresa su masa relativa molar. Así, por ejemplo, un mol gramo de aluminio tiene una masa de 26.98 g y contiene 6.023 ·1023 átomos.
![]()
Veamos unos ejercicios de aplicación:
La plata natural está constituida por una mezcla de dos isótopos de números másicos 107 y 109. Sabiendo que abundancia isotópica es la siguiente: 107Ag =56% y 109Ag =44%. Deducir el peso atómico de la plata natural.
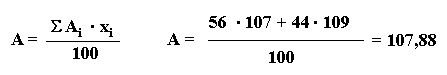
Determinar la masa atómica del galio, sabiendo que existen dos isótopos 69Ga y 71Ga, cuya abundancia relativa es, respectivamente, 60,2% y 39,8%. Indica la composición de los núcleos de ambos isótopos sabiendo que el número atómico del galio es 31.
Masa atómica = 69 · 0,602 + 71 · 0,398 = 69,7 u
Núcleo del 6931Ga: 31 protones y 38 neutrones (69 - 31)
Núcleo del 7131Ga: 31 protones y 40 neutrones (71 - 31).
4 comentarios
nerea -
carlos -
anonimo -
asda -