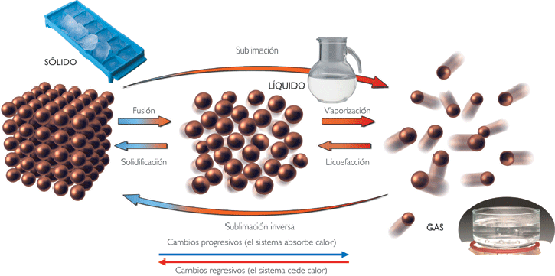
Cambios de estado
Os propongo una visita a esta página interactiva para comprender los estados de agregación de la materia y los cambios de estado:
El calor y los cambios de estado. Calor latente
En algunas circunstancias, cuando se aporta energía calorífica a un cuerpo, este no aumenta su temperatura, sino que esa energía se invierte en modificar las fuerzas que unen unas moléculas con otras, provocando que la materia cambie su estado de agregación. Los cambios de estado más corrientes son sólido ↔ líquido y líquido ↔ gas. Los cambios sólido ↔ gas son mas raros y, en general, se producen en circunstancias no ordinarias.
La materia se presenta en tres estados: sólido, líquido y gaseoso. Según las condiciones externas de presión y temperatura, un mismo cuerpo puede existir en cualquiera de ellos.
Los cambios de estado se caracterizan por lo siguiente:
- No cambian la naturaleza de la sustancia.
- Se producen a temperatura constante para cada presión.
- La sustancia absorbe o cede calor. El calor invertido en el proceso para la unidad de masa recibe el nombre de calor latente de cambio de estado.
- El valor de la temperatura a la que se producen y el valor del calor latente correspondiente son característicos de cada cambio de estado y de la naturaleza de la sustancia.
La energía necesaria para que una sustancia cambie de estado es:
Q = m · L
Donde m es la masa de la sustancia considerada y L es una propiedad característica de cada sustancia, llamada calor latente. El calor latente se mide en J/kg en unidades del SI.
La representación gráfica de la temperatura de un sistema físico en función del tiempo, cuando el sistema absorbe o libera un calor constante por unidad de tiempo, se llama gráfica de calentamiento o enfriamiento.



0 comentarios