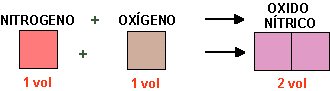PROBLEMAS DE DISOLUCIONES 1º Bachillerato.-
1 - ¿Cuántos gramos de ácido nítrico son necesarios para preparar 1,5 litros de
disolución acuosa de dicho ácido 0,6 M?.
(Solución: 56,7 g)
2 - Una disolución 0,25 m de cloruro de sodio contiene 58,5 g de soluto. ¿Qué cantidad de disolvente (agua) tiene?.
(Solución: 4 Kg)
3.- La concentración de un ácido sulfúrico comercial es del 93 %. ¿Qué cantidad de ácido sulfúrico habrá en 650 g de ácido sulfúrico comercial?
Sol: 604,5 g.
4-.Se prepara una disolución con 5 g de hidróxido de sodio en 25 g de agua destilada. Si el volumen final es de 27,1 ml, calcula la concentración de la disolución en:
a) Porcentaje en masa b) gramos por litro c) Molaridad.
Sol.: 16,7 % 184,5 g/l 4,6 M
5.-Se disuelven 12 g de hidróxido sódico y se completa con agua hasta 250 ml. Halla:
a) el número de moles de soluto; b) La Molaridad;
Sol.: a) 0,3 moles; b) 1,2 M; c) V= 40 ml.
4.-Tenemos una disolución, al 10 %, de C12H22O11. Si disponemos de 200 g, ¿qué cantidad de azúcar habrá que añadir para conseguir que el contenido en C12H22O11 suba al 20 %?.
(Solución: 25 g)
5.- Disponemos de 25 cc de HNO3, 16 M. Si se diluyen hasta que ocupen 0,4 litros,
¿qué molaridad tendrá la nueva disolución?
(Solución: 1M)
6.- Se disuelven 180 g de sosa caústica en 800 g de agua. La densidad de la disolución, a 20ºC resulta ser de 1,340 g/cc. Calcula la concentración de la disolución en:
a) Tanto por ciento en peso b) Gramos por litro
c) Molaridad
d) Molalidad
(Solución: 18,36%; 246,0g/l; 6,15M; 5,625m)
7º.- Una disolución acuosa de hidróxido de sodio al 20 % en masa tiene una densidad de 1,25 g/cc. Halla:
a) La masa de la disolución que contiene 36 g de hidróxido de sodio.
b) El volumen de disolución que debemos tomar si necesitamos 40 g de NaOH.
c) La masa de hidróxido de sodio contenida en 300 g de disolución.
d) La masa de hidróxido de sodio que hay disuelta en 200 ml de disolución.
(Solución: 180 g; 160cc; 60g; 50g)
8.- Se ha preparado una disolución de yoduro de potasio cuya concentración es 60g/l.
a) ¿Cuánto yoduro hay disuelto en 150 cc de la disolución?.
b) ¿Qué volumen de disolución hay que tomar si se precisan 24 g de yoduro?.
(Solución: 9g; 0,4 l)
9.- Una disolución de hidrógenosulfito de sodio al 25 % en masa tiene una densidad de 1,12 Kg/l. Expresa la concentración en g/l.
(Solución: 280 g/l)
10.- Una disolución de ácido sulfúrico, de concentración 720 g/l, tiene una densidad de
1,20 g/ml. Expresa su concentración en tanto por ciento en masa.
(Solución: 60%)
11.- - Queremos obtener una disolución 0,08 M de ácido fosfórico, y la que tenemos en
el laboratorio es 0,32 M. Si partimos de 50 cc de la disolución del laboratorio, ¿hasta qué volumen debemos diluirla?.
(Solución: hasta 200 cc)
12.- Se desea preparar un litro de disolución 1M de ácido sulfúrico a partir de un ácido comercial cuya etiqueta indica su concentración centesimal 97,6 % y su densidad 1,85 g/cm3. Determina:
a) La molaridad de dicho ácido. B) El volumen necesario para preparar la disolución pedida.
Sol.: 18,424 M; V= 54,3 cm3
13.- ¿Cuántos gramos de ácido nítrico hay en 20 ml de disolución 0,02 M? Determina la cantidad de agua que habrá que añadir a los 20 ml para qué la disolución pase a ser 0,0125 M.
Sol.: 0,0252g; 12 ml de agua.
14.-Queremos preparar 2 L de disolución de ácido clorhídrico 0,5 M. Calcula el volumen de ácido clorhídrico comercial del 37,5% y densidad 1,19 g/cm3 que debemos añadir al matriz aforado, así como la cantidad de agua destilada necesaria para completar el volumen de disolución
Sol: 81,8 ml; 1918,2 ml.
15.- En 40 g de agua se disuelven 5 g de ácido sulfhídrico . La densidad de la disolución formada es de 1,08 g/cm3.. Calcula el porcentaje en masa y la molaridad.
Sol.: 11,11 % y 3,53 M
16.-Partiendo de una disolución 2 M de ácido nítrico. Indica como prepararías 1 L de otra disolución del mismo ácido, pero de concentración 1 M.
17.- Mezclamos 400 ml de una disolución 0,5 M de amoniaco con 100 ml de una disolución 2 M de la misma sustancia. ¿Qué concentración en molaridad tendrá la disolución restante?
Sol.: 0,8 M
18.-Queremos preparar 2 l de disolución de cloruro de hidrógeno 0,5 M. Calcula el volumen de ácido comercial del 37,5% y densidad 1,19 g/cm3 que debemos añadir al matraz aforado, así como la cantidad de agua destilada necesaria para completar el volumen de disolución.
Sol.: 81,8 ml y 1918,2 ml
19.- Calcula la cantidad, en gramos, de nitrato de potasio y agua destilada necesarios para preparar 250 cm3 de disolución al 20 %. La densidad de la disolución es de 1,2 g/cm3.
Sol.: 60 g de nitrato de potasio y 240 g de agua destilada.
20.- Si mezclamos 250ml de ácido nítrico 0.5M y medio litro de agua, ¿cuál será la molaridad de la disolución resultante? ¿Cuántos gramos de ácido nítrico HNO3 contendrá?
21.- Un ácido clorhídrico comercial HCl contiene un 37% en masa de ácido clorhídrico y una densidad de 1,19 g/ml. ¿Qué cantidad de agua se debe añadir a 20ml de este ácido para que la disolución resultante sea 0,1M?
22.- Una disolución se ha preparado disolviendo 20 g de ácido sulfúrico puro en 80 g de agua. Si su densidad es de 1,143 g/ml:
a) ¿Qué concentración de ácido - en % en peso - hay en esa disolución?.
b) ¿Cuál es su molaridad?. c) ¿Cuál es su molalidad?.
(Solución: 20%; 2,33M; 2,55m)
23.- Una disolución saturada de cloruro de potasio, a 20ºC, contiene 296 g por litro de disolución. La densidad es 1,17 g/ml. Calcúlese su molaridad y su molalidad.
(Solución: 3,97M; 4,55 m)
24.- Hallar la densidad de una disolución de amoniaco que contiene 20,3% en peso de amoniaco y es 11M.
(Solución: 0,921 g/cc)
25- La densidad de una disolución acuosa de 1,17 M de sulfato de zinc es de 1,81
g/ml a 15ºC. ¿Cúal es el porcentaje, en peso, de soluto en la disolución? ¿Cuál será la molalidad de esa disolución?.
(Solución: 10,41%; 0,72m)
26.- Determínese la densidad de una disolución acuosa de ácido clorhídrico, 6 M y
6,85 m.
(Solución: 1,095g/ml)
27.- Se han disuelto 180 g de NaOH en agua hasta formar 500 cc de disolución cuya densidad es 1,12 g/cc. Determina la molaridad y la molalidad de la disolución.
(Solución: 9M, 10,11m)
28.-- Una disolución 5 molal de glicerina (C3H8O3) en agua tiene una densidad de 1,2
Kg/l. Halla:
a) La cantidad de glicerina y agua que hay en 250 g de disolución.
b) La cantidad de glicerina y agua que hay en 250ml de disolución.
(Solución: 76,8 g de glicerina y 171,2 g de agua; 94,6 g de glicerina y 205,4 g agua)
29.--Calcula la concentración, expresada en % en masa y en mol/kg disolvente, de una disolución de NaOH 6,25 M cuya densidad es 1,25 Kg/l.
(Solución: 20%; 6,25mol/kg)
30.- Una disolución de NaOH 6,25 m tiene una densidad de 1,25 g/ml. Expresa su concentración en mol/l, g/l y % en masa.
(Solución: 250 g/l; 6,25M; 20%)
31.- Queremos preparar 100 ml de disolución 1,25 M de HCl. ¿Qué volumen de ácido
al 40 %, y de densidad 1,20 g/ml, deberemos tomar?.
(Solución: 9,5 ml)
32.- ¿Cuál es la molaridad de una disolución de ácido sulfúrico del 63 % y 1,700 g/cc de densidad?. ¿Qué volumen de dicha disolución deberemos tomar si se quiere preparar 3 litros de disolución 0,25 M del mismo ácido?.
(Solución: 10,93M; 68,6 cc)
33.- Se disuelven 90 g de glucosa (C6H12O6) en 0,500 Kg de una disolución 0,2 molal de glucosa.
a) ¿Cuál es la molalidad de la solución resultante?. b) ¿Cuál es el porcentaje en peso de soluto?.
(Solución: 1,24 m; 18,2%)
34.- Se añaden 500 ml de ácido sulfúrico 2,5 M a 800 ml de ácido sulfúrico 3,75 M. Suponiendo que el volumen total de la disolución, después de la mezcla, es de 1310 ml, ¿cuál es la molaridad de la disolución resultante?.
(Solución: 3,24 M)
35.- Para concentrar una disolución de sulfito de amonio 2 M, se toman 250 ml de la misma, se les añade 174 g de sulfito de amonio y se completa el volumen de la disolución a 500 cc, utilizando un matraz aforado y agua destilada. Determina la concentración de la disolución resultante.
(Solución: 4M)
36.-Se diluyen 100 ml de disolución acuosa de bromuro de amonio 2 M vertiéndolos en un matraz aforado de 250 ml y enrasando éste con agua destilada. ¿Cuál es la concentración de la disolución resultante?.
(Solución: 0,8M)
37.- En un matraz aforado de 250 ml se mezclan 150 cc de disolución NaOH de concentración 80 g/l con 100 ml de disolución de NaOH 6 M, enrasando el matraz, a continuación, con agua destilada. Halla la concentración, expresada en g/l y en mol/l, de la disolución obtenida.
(Solución: 3,6 M; 144 g/l)
38.- Hallar la molalidad de la disolución resultante al añadir 125 cc de agua a 150 g de disolución de NaOH 5 m.
(Solución: 2,5 m)
39.- Hallar la molalidad de la disolución obtenida al añadir 5 g de NaOH a 150 g de disolución de NaOH 5 m.
(Solución: 6 m)
40.- La concentración de un ácido sulfúrico comercial es del 93 %. ¿Qué cantidad de ácido sulfúrico habrá en 650 g de ácido sulfúrico comercial?
Sol: 604,5 g.
30º-Se prepara una disolución con 5 g de hidróxido de sodio en 25 g de agua destilada. Si el volumen final es de 27,1 ml, calcula la concentración de la disolución en:
a) Porcentaje en masa b) gramos por litro c) Molaridad.
Sol.: 16,7 % 184,5 g/l 4,6 M
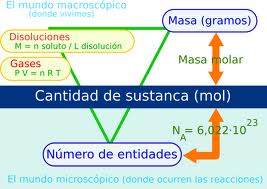


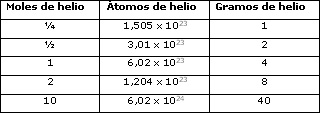
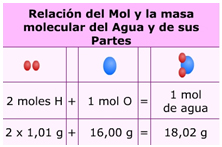
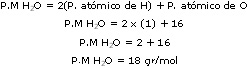
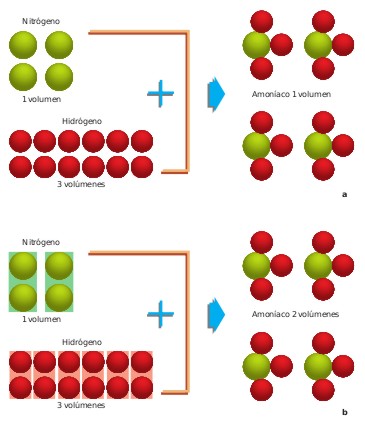

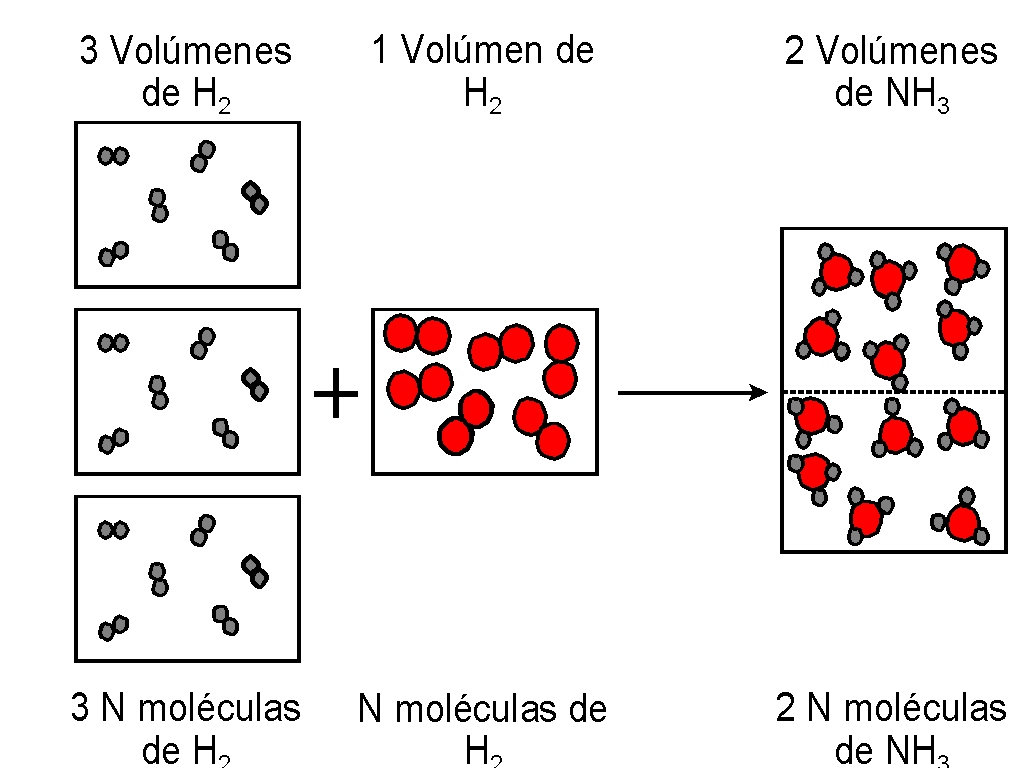
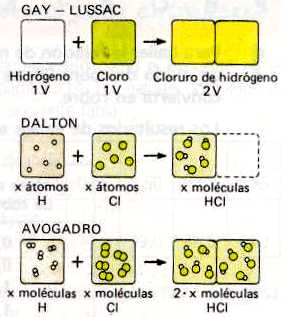
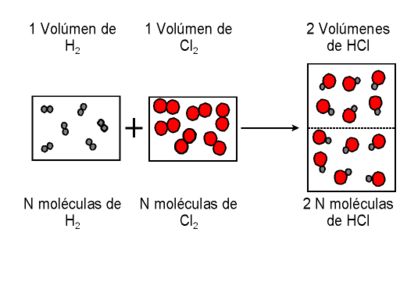
 GAY-LUSSAC formuló en 1808 la ley de los volúmenes de combinación que lleva su nombre. Al obtener vapor de agua a partir de los elementos (sustancias elementales) se había encontrado que un volumen de oxígeno se une con dos volúmenes de hidrógeno formándose dos volúmenes de vapor de agua; todos los volúmenes gaseosos medidos en las mismas condiciones de presión y temperatura.
GAY-LUSSAC formuló en 1808 la ley de los volúmenes de combinación que lleva su nombre. Al obtener vapor de agua a partir de los elementos (sustancias elementales) se había encontrado que un volumen de oxígeno se une con dos volúmenes de hidrógeno formándose dos volúmenes de vapor de agua; todos los volúmenes gaseosos medidos en las mismas condiciones de presión y temperatura.