MODELOS ATÓMICOS
De qué están formadas las cosas?
Todos nos hemos preguntado esta cuestión alguna vez, y hemos dicho, pues de moléculas, atomos..., pero... ¿Por qué no los vemos? pues pincha AQUI y lo verás.
Esta pregunta fue hecha por los científicos desde el siglo V a. C. Uno de los primeros que intentaron responderla fue el filósofo griego Demócrito, quien dijo que la materia estaba formada por partículas indivisibles muy pequeñas a las que llamó átomos (sin división).
En 1808, John Dalton, científico y profesor inglés, formuló una definición precisa acerca de la estructura de la materia. Esta primera teoría marca el inicio de la era moderna de la química. Sus ideas se pueden expresar del siguiente modo:
1. Los elementos están formados por partículas extremadamente pequeñas llamadas átomos. Todos los átomos de un elemento dado son idénticos en tamaño, masa y propiedades químicas. Los átomos de un elemento difieren de los átomos de todos los demás elementos.
2. Los compuestos están formados por átomos de más de un elemento. En cualquier compuesto, la relación entre el número de átomos de cualquier par de elementos presentes es un entero o una fracción simple.
3. Una reacción química implica sólo una separación, combinación o reordenamiento de átomos; éstos no se crean ni se destruyen.
Para visualizar esta teoría pulsa "Teoría tómica de dalton" y de forma genérica "Modelos atómicos"
Con esta teoría, Dalton no intentó describir la estructura o composición de los átomos; sin embargo, logró visualizar que, por ejemplo, las propiedades diferentes de los elementos hidrógeno y oxígeno se pueden explicar suponiendo que ambos átomos no son iguales. Por otra parte, intentó explicar cómo se unen estos elementos para formar un compuesto, señalando que se requiere un número correcto de átomos. Por ejemplo en la molécula de agua, H2O, se requieren dos átomos de hidrógeno y uno de oxígeno.
Ejercicio:
Clasifica en elementos, compuestos y mezclas: cloruro de sodio (NaCl); sacarosa o azúcar común; plata; agua azucarada; óxido de mercurio (II) (HgO); cobre; aire; y nitrato de potasio (KNO3).
Estructura del átomo
Luego de la formulación de la teoría de Dalton, a partir de 1850 comenzó una serie de investigaciones para determinar qué hay dentro de estas partículas indivisibles que conforman la materia. Las investigaciones dieron lugar al descubrimiento de tres partículas subatómicas: el electrón, el protón y el neutrón.
Electrones
Joseph Thompson realizó un experimento que le permitió descubrir pequeñas partículas con carga negativa a las que llamó electrones. Este experimento se realiza en un equipo de descarga eléctrica que consiste en una placa con carga positiva llamada ánodo, que atrae partículas con carga negativa (o electrones) emitidas por el cátodo (placa con carga negativa). El haz de electrones forma lo que los primeros investigadores llamaron rayo catódico. Este rayo viaja hasta incidir en la superficie interna del extremo opuesto del tubo. La superficie está recubierta con un material fluorescente, como sulfuro de zinc, de manera que se observa una intensa fluorescencia o emisión de luz cuando la superficie es bombardeada por los electrones. Para conocer la carga de los rayos catódicos, a este sistema se le agregó un imán para ver si estas partículas eran o no desviadas por el campo magnético del imán. Se observó que en presencia de este campo las partículas eran desviadas de su trayectoria; sin embargo, en ausencia del campo magnético las partículas siguen una trayectoria rectilínea hasta chocar con la superficie recubierta con material fluorescente.
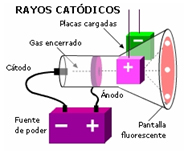
Figura 1: Esquema de un tubo de rayos catódicos de Thompson
Esto dió lugar al "Modelo atómico de Thompson", pinchalo para comprenderlo mejor. También puedes comprenderlo con "Modelo Atómicos" y verlo de forma animada
Lo anterior permitió establecer que la carga de los rayos catódicos o electrones es negativa e igual a -1.6 x 10-19C y su masa igual a 9.09 x 10-28 g.
A partir de este experimento Thompson imaginó el átomo como una esfera sólida con cargas positivas a la cual se insertan electrones en la superficie. De modo que cuando se aplica la suficiente energía, dichos electrones salen del átomo como rayos catódicos. Esto caracteriza al átomo como eléctricamente neutro.

Figura 2: Modelo atómico de Thompson
Protones
En 1910, Ernest Rutherford (quién estudió bajo la dirección de Thompson) decidió usar partículas a (o núcleos de helio) para probar la estructura de los átomos. Las partículas a son más grandes y pesadas que los electrones y tienen un equivalente a dos cargas positivas.
Rutherford efectuó una serie de experimentos en los cuales se utilizaron hojas delgadas de oro y otros metales como blancos de partículas a emitidas por una fuente radiactiva. Como resultado de estas pruebas observó tres trayectorias:
1. La mayoría de las partículas penetraba la hoja sin desviarse o con ligera desviación.
2. Algunas partículas a se desviaban atravesando la lámina.
3. Pocas partículas chocaban con la lámina regresando hacia su fuente de emisión.
Con esto, Rutherford dejó a un lado el modelo atómico planteado por Thompson para plantear uno nuevo "Modelo Atómico de Rutherfor". Según el "Modelo de Rutherford", la mayor parte de un átomo debe ser espacio vacío (para que las partículas alfa pasen a través de la lámina sin desviar su trayectoria). Las cargas positivas del átomo se encuentran todas concentradas en un punto central llamado núcleo, de modo que cuando las partículas a se acercan al núcleo son fuertemente desviadas por repulsión electroestática. Por último, si una partícula a viaja directamente hacia el núcleo experimenta una repulsión que invierte por completo el sentido de su movimiento y la hace regresar hasta su fuente de emisión.
A las partículas positivas que están dentro del núcleo se les llamó protones y tienen la misma cantidad de carga que un electrón, pero positiva. Más adelante se determinó que la masa de un protón es 1.672 x 10-24 g.
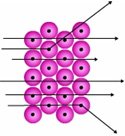
Figura 3: Trayectoria de partículas alfa (a) al atravesar una lámina de oro
Resumiendo, los científicos de la época percibían que la estructura del átomo consiste en un núcleo donde se concentra la mayor parte de la masa total del átomo, pero que ocupa un pequeño volumen de éste. Los átomos son eléctricamente neutros y concentran la carga positiva en el núcleo, mientras que las cargas negativas se encuentran alrededor de éste.
Neutrones
El siguiente problema referente a la estructura atómica se origina al comparar los dos átomos más pequeños que existen: el hidrógeno y helio. El hidrógeno tiene sólo un protón, mientras que el helio tiene dos protones. Por tanto, la relación de masas entre ambos debería ser 2:1; sin embargo, la relación es 4:1. Debido a esto, se supuso que en el interior del núcleo existía una tercera partícula, sin carga (para mantener la electroneutralidad del átomo). A esta partícula se le llamó neutrón, y su descubrimiento se le atribuye al científico James Chadwick. La masa de estas partículas es ligeramente mayor que la masa de los protones: 1.674 x 10-24 g.
Al modelo atómico que planteó Rutherford se le llamó modelo planetario del átomo, ya que propuso que los electrones giran en torno al núcleo en órbitas definidas, tal como lo hacen los planetas en torno al Sol.
Modelo Atómico de Borh
Borh se basó en el átomo de hidrógrno para hacer el modelo que lleva su nombre. Bohr intentaba realizar un modelo atómico capaz de explicar la estabilidad de la materia y los espectros de emisión y absorción discretos que se observan en los gases. Describió el átomo de hidrógeno con un protón en el núcleo, y girando a su alrededor un electrón. El modelo atómico de Bohr partía conceptualmente del modelo atómico de Rutherford y de las incipientes ideas sobre cuantización que habían surgido unos años antes con las investigaciones de Max Plank y Albert Einstein. Debido a su simplicidad el modelo de Bohr es todavía utilizado frecuentemente como una simplificación de la estructura de la materia.
En este modelo los electrones giran en órbitas circulares alrededor del núcleo, ocupando la órbita de menor energía posible, o la órbita más cercana posible al núcleo. El electromagnetismo clásico predecía que una partícula cargada moviéndose de forma circular emitiría energía por lo que los electrones deberían colapsar sobre el núcleo en breves instantes de tiempo. Para superar este problema Bohr supuso que los electrones solamente se podían mover en órbitas específicas, cada una de las cuales caracterizada por su nivel energético. Cada órbita puede entonces identificarse mediante un número entero n que toma valores desde 1 en adelante. Este número "n" recibe el nombre de Número Cuántico Principal.
Bohr supuso además que el momento angular de cada electrón estaba cuantizado y sólo podía variar en fracciones enteras de la constante de Planck. De acuerdo al número cuántico principal calculó las distancias a las cuales se hallaba del núcleo cada una de las órbitas permitidas en el átomo de hidrógeno.
Estos niveles en un principio estaban clasificados por letras que empezaban en la "K" y terminaban en la "Q". Posteriormente los niveles electrónicos se ordenaron por números. Cada órbita tiene electrones con distintos niveles de energía obtenida que después se tiene que liberar y por esa razón el electrón va saltando de una órbita a otra hasta llegar a una que tenga el espacio y nivel adecuado, dependiendo de la energía que posea, para liberarse sin problema y de nuevo volver a su órbita de origen.
Sin embargo no explicaba el espectro de estructura fina que podría ser explicado algunos años más tarde gracias al modelo atómico de Sommerfeld. Históricamente el desarrollo del modelo atómico de Bohr junto con la dualidad onda-corpúsculo permitiría a Erwin Schrödinger descubrir la ecuación fundamental de la mecánica cuántica.
Postulados de Bohr
En 1913, Niels Bohr desarrolló su célebre modelo atómico de acuerdo a tres postulados fundamentales:1
Primer postulado
Los electrones describen órbitas circulares en torno al núcleo del átomo sin radiar energía.
La causa de que el electrón no radie energía en su órbita es, de momento, un postulado, ya que según la electrodinámica clásica un carga en movimiento acelerado debe emitir energía en forma de radiación.
Para conseguir el equilibrio en la órbita circular, las dos fuerzas que siente el electrón: la fuerza coulombiana, atractiva, por la presencia del núcleo y la fuerza centrífuga, repulsiva por tratarse de un sistema no inercial, deben ser iguales en módulo en toda la órbita. Esto nos da la siguiente expresión:
Donde el primer término es la fuerza eléctrica o de Coulomb, y el segundo es la fuerza centrífuga; k es la constante de la fuerza de Coulomb, Z es el número atómico del átomo, e es la carga del electrón, me es la masa del electrón, v es la velocidad del electrón en la órbita y r el radio de la órbita.
En la expresión anterior podemos despejar el radio, obteniendo:
Y ahora con ésta ecuación y sabiendo que la energía total es la suma de las energías cinética y potencial:
Donde queda expresada la energía de una órbita circular para el electrón en función del radio de dicha órbita.
Segundo postulado
No todas las órbitas para electrón están permitidas, tan solo se puede encontrar en órbitas cuyo radio cumpla que el momento angular, L, del electrón sea un múltiplo entero de 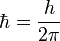 . Esta condición matemáticamente se escribe:
. Esta condición matemáticamente se escribe:
con
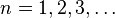
A partir de ésta condición y de la expresión para el radio obtenida antes, podemos eliminar v y queda la condición de cuantización para los radios permitidos:
con
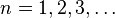 ; subíndice introducido en esta expresión para resaltar que el radio ahora es una magnitud discreta, a diferencia de lo que decía el primer postulado.
; subíndice introducido en esta expresión para resaltar que el radio ahora es una magnitud discreta, a diferencia de lo que decía el primer postulado. Ahora, dándole valores a n, número cuántico principal, obtenemos los radios de las órbitas permitidas. Al primero de ellos (con n=1), se le llama radio de Bohr:
expresando el resultado en ångström.
Del mismo modo podemos ahora sustituir los radios permitidos rn en la expresión para la energía de la órbita y obtener así la energía correspondiente a cada nivel permitido:
Igual que antes, para el átomo de Hidrógeno (Z=1) y el primer nivel permitido (n=1), obtenemos:
que es la llamada energía del estado fundamental del átomo de Hidrógeno.
Y podemos expresar el resto de energías para cualquier Z y n como:
Tercer postulado
El electrón solo emite o absorbe energía en los saltos de una órbita permitida a otra. En dicho cambio emite o absorbe un fotón cuya energía es la diferencia de energía entre ambos niveles. Este fotón, según la ley de Planck tiene una energía:
donde ni identifica la órbita inicial y nf la final, y ν es la frecuencia.
Entonces las frecuecias de los fotones emitidos o absorbidos en la transición serán:
A veces, en vez de la frecuencia se suele dar la inversa de la longitud de onda:
Ésta última expresión fue muy bien recibida porque explicaba teóricamente la formula fenomenológica hallada antes por Balmer para describir las líneas observadas desde finales del siglo XIX en la desexcitación del Hidrógeno, que venían dadas por:
con
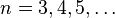 , y donde RH es la constante de Rydberg para el hidrógeno. Y como vemos, la expresión teórica para el caso nf = 2, es la expresión predicha por Balmer, y el valor medido experimentalmente de la constante de Rydberg (1.097107m − 1), coincide con el valor de la formula teórica.
, y donde RH es la constante de Rydberg para el hidrógeno. Y como vemos, la expresión teórica para el caso nf = 2, es la expresión predicha por Balmer, y el valor medido experimentalmente de la constante de Rydberg (1.097107m − 1), coincide con el valor de la formula teórica.
Se puede demostrar que este conjunto de hipótesis corresponde a la hipótesis de que los electrones estables orbitando un átomo están descritos por funciones de onda estacionarias. Un modelo atómico es una representación que describe las partes que tiene un átomo y como están dispuestas para formar un todo. Basándose en la constante de Planck 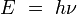 consiguió cuantizar las órbitas observando las líneas del espectro.
consiguió cuantizar las órbitas observando las líneas del espectro.
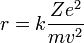
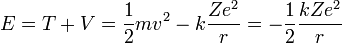
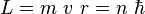
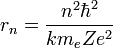
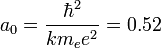
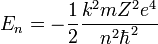
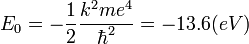
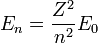
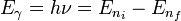
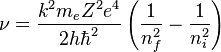
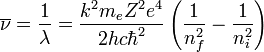
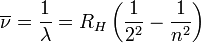
1 comentario
Juan -
Un saludo