HIPÓTESIS DE AVOGADRO
Las últimas partículas de los gases elementales no son átomos sino agregados de átomos (en general dos), a los que dio el nombre de moléculas (del latín pequeñas moles o masas)
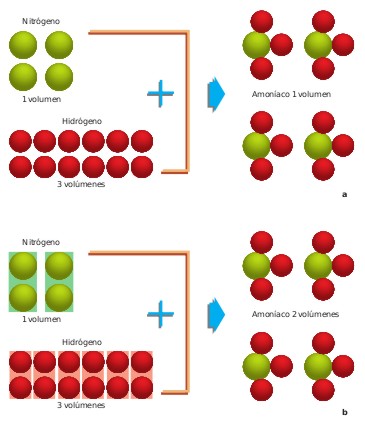
En volúmenes iguales de todos los gases, medidos en las mismas condiciones de presión y temperatura, existen igual número de moléculas.
Avogadro admite de la teoría atómica de Dalton el que los átomos son indestructibles, y sus demás postulados, pero no así sus ideas sobre la composición de las moléculas tanto de las sustancias elementales como de los compuestos. A la misma conclusión que Avogadro e independientemente de él, llegó AMPERE en 1814. Para AVOGADRO y AMPÉRE las últimas partículas de los elementos gaseosos eran también compuestas aunque formadas de átomos iguales.

Los átomos constituyen las unidades últimas que toman parte en los cambios químicos mientras que las moléculas son las partículas físicamente separadas que integran los gases. En las reacciones entre cuerpos gaseosos las moléculas se escinden, en general, en sus átomos constituyentes los que se unen en la transformación de manera distinta.
Por ejemplo, la relación en la formación de agua debería ser, según Dalton, 1 volumen de hidrógeno / 1 volumen de oxígeno / 1 volumen de agua, y no de 2/1/2 como se encontró, experimentalmente. Este hecho lo explica Avogadro al suponer que las moléculas del hidrógeno, cloro, nitrógeno, oxígeno.... son diatómicas, y que las moléculas de agua, amoniaco, etc., no tienen por qué contener forzosamente sólo dos átomos. Si el agua, por ejemplo, tiene en su molécula dos átomos de hidrógeno y uno de oxígeno (H2O), puede explicarse la relación de volúmenes de combinación conforme indica la figura.
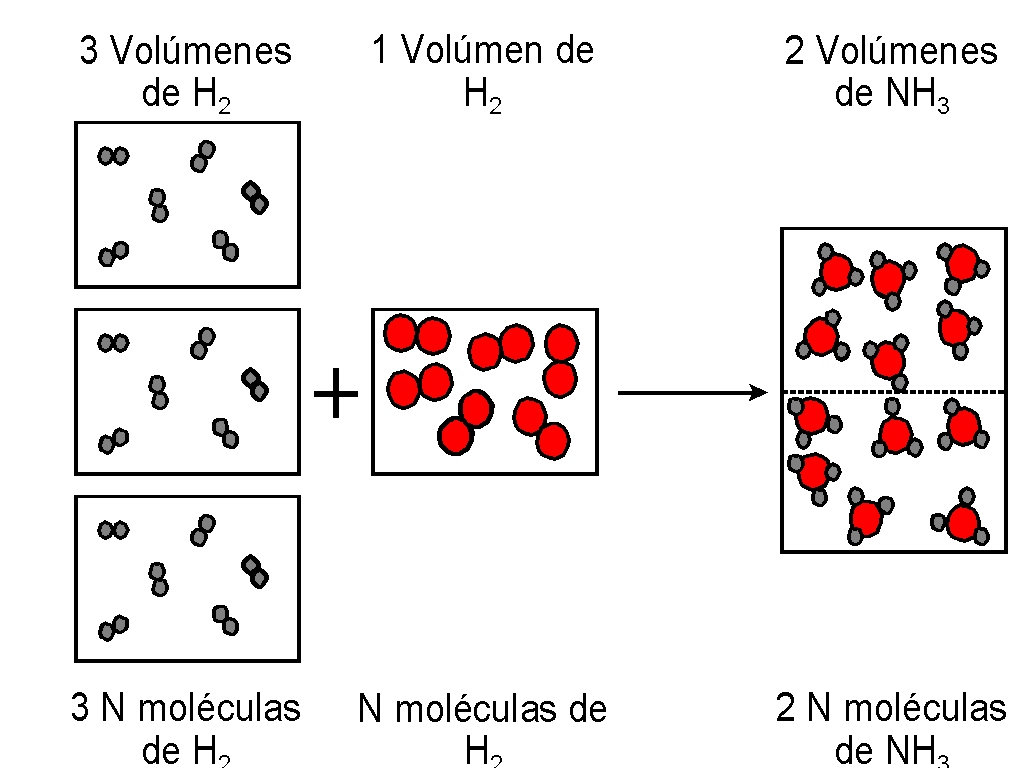
De forma análoga se puede justificar los resultados obtenidos en la formación del cloruro de hidrógeno.
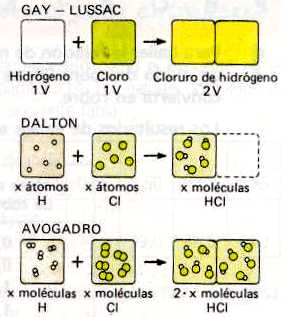
A pesar de que con la teoría de Avogadro se explicaba la ley de los volúmenes de combinación, fue desechada en su tiempo. Por una parte, a BERZELIUS le parecía imposible que dos átomos iguales pudieran unirse, pues juzgaba que el enlace entre átomos sólo podía ocurrir por fuerzas eléctricas opuestas. Por otra, Dalton consideró como inexactos los resultados de Gay-Lussac. Se olvidó así la hipótesis de Avogadro hasta medio siglo después, en 1858 una publicación del químico italiano CANNIZZARO daba a conocer claramente su significado y aplicación. Para CANNIZZARO la hipótesis de Avogadro le proporcionó un sencillo método para determinar pesos moleculares relativos de gases, porque la densidad de un gas sería proporcional a su peso molecular. De ahí pudo calcular los pesos atómicos y obtener una escala correcta de los mismos.
El éxito alcanzado por los resultados de Cannizzaro confirmaron la hipótesis de Avogadro, que quedó convertida así en una ley y que, a su vez, complementó la teoría atómica de Dalton.
0 comentarios