EJERCICIOS Y PROBLEMAS DE SELECTIVIDAD: MODELOS ATÓMICOS Y SISTEMA PERIÓDICO
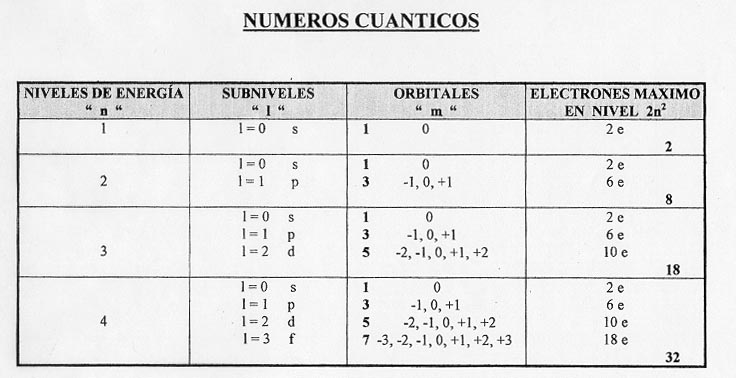
Aquí tenéis los ejercicios y problemas de los últimos años para el bloque: Átomo y Sistema Periódico.
2.- a) Escriba las configuraciones electrónicas de los iones siguientes: Na+(Z=11) y F- (Z = 9).b) Justifique que el ion Na+ tiene menor radio que el ion F-. c) Justifique que la energía de ionización del sodio es menor que la del flúor.
Examen-1(A)-2002
3.- Dados los elementos A (Z=13), B (Z=9) y C (Z=19)
a) Escriba sus configuraciones electrónicas.
b) Ordénelos de menor a mayor electronegatividad.
c) Razone cuál tiene mayor volumen.
Examen-2(B)-2002
2.- a) Defina afinidad electrónica.
b) ¿ Qué criterio se sigue para ordenar los elementos en la tabla periódica?
c) ¿ Justifique cómo varía la energía de ionización a lo largo de un periodo?
Examen-3(A)-2002
2.- a) ¿Por qué el volumen atómico aumenta al bajar en un grupo de la tabla periódica?
b) ¿Por qué los espectros atómicos son discontinuos?
c) Defina el concepto de electronegatividad.
Examen-4(A)-2002
2.- Dados los elementos cuyos números atómicos son 7, 17 y 20.
a) Escriba sus configuraciones electrónicas.
b) Razone a qué grupo y periodo de la tabla periódica pertenecen.
c) ¿Cuál será el ion más estable de cada uno? Justifique la respuesta.
Examen-5(A)-2002
2.- Razone si las siguientes configuraciones electrónicas son posibles en un estado fundamental o en un estado excitado:
a) 1s2 2s2 2p4 3s1.
b) 1s2 2s2 2p6 3s2 3p1.
c) 1s2 2s2 2p6 2d10 3s2.
Examen-6(B)-2002
2.- a) Indique cuáles de los siguientes grupos de números cuánticos son posibles para un
electrón en un átomo: (4,2,0,+1/2); (3,3,2, -1/2); (2,0,1,+1/2); (3,2,-2,-1/2); (2,0,0,-1/2).
b) De las combinaciones de números cuánticos anteriores que sean correctas, indique el
orbital donde se encuentra el electrón.
c) Enumere los orbitales del apartado anterior en orden creciente de energía.
Examen-1(A)-2003
2.- Dado el elemento de Z = 19:
a) Escriba su configuración electrónica.
b) Indique a qué grupo y periodo pertenece.
c) ¿Cuáles son los valores posibles que pueden tomar los números cuánticos de su electrón
más externo?
Examen-2(A)-2003
2.- Dadas las siguientes configuraciones electrónicas de la capa de valencia:
1) ns1 2) ns2 np4 3) ns2 np6
a) Indique el grupo al que corresponde cada una de ellas.
b) Nombre dos elementos de cada uno de los grupos anteriores.
c) Razone cuáles serán los estados de oxidación más estables de los elementos de esos
grupos.
Examen-4(B)-2003
2.- a) Defina el concepto de energía de ionización de un elemento.
b) Justifique por qué la primera energía de ionización disminuye al descender en un grupo de la tabla periódica.
c) Dados los elementos F, Ne y Na, ordénelos de mayor a menor energía de ionización.
Examen-5(A)-2003
3.- a) Escriba las configuraciones electrónicas del cloro (Z = 17) y del potasio (Z = 19). b) ¿Cuáles serán los iones más estables a que darán lugar los átomos anteriores?
c) ¿Cuál de esos iones tendrá menor radio?
Examen-6(B)-2003
2.- Los números atómicos de los elementos A, B y C son, respectivamente, 19, 31 y 36.
a) Escriba las configuraciones electrónicas de estos elementos.
b) Indique qué elementos, de los citados, tienen electrones desapareados.
c) Indique los números cuánticos que caracterizan a esos electrones desapareados.
Examen-1(A)-2004
2.-Dados los siguientes grupos de números cuánticos:
A(2,2,1,1/2); B(3,2,0,-1/2);C(4,2,2,0); D(3,1,1,1/2)
a)Razone qué grupos no son válidos para caracterizar un electrón
b)Indique a qué orbitales corresponden los grupos permitidos
Examen -2(A)-2004
2.- La configuración electrónica de un átomo excitado de un elemento es 1s2 2s2 2p6 3s2 3p6 5s1.
Razone cuáles de las afirmaciones siguientes son correctas y cuáles falsas para ese elemento:
a) Pertenece al grupo de los alcalinos.
b) Pertenece al periodo 5 del sistema periódico.
c) Tiene carácter metálico.
Examen-3(A)-2004
2.- Dadas las especies: Cl- (Z = 17), K+ (Z = 19) y Ar (Z = 18):
a) Escriba la configuración electrónica de cada una de ellas.
b) Justifique cuál tendrá un radio mayor.
Examen-4(A)-2004
2.- Considere la serie de elementos: Li, Na, K, Rb y Cs.
a) Defina Energía de ionización.
b) Indique cómo varía la Energía de Ionización en la serie de los elementos citados.
c) Explique cuál es el factor determinante de esta variación.
Examen-5(A)-2004
3.- Los números atómicos de los elementos A, B y C son respectivamente 20, 27 y 34.
a) Escriba la configuración electrónica de cada elemento.
b) Indique qué elemento es el más electronegativo y cuál el de mayor radio.
c) Indique razonadamente cuál o cuáles de los elementos son metales y cuál o cuáles no
metales.
Examen-6(B)-2004
2.- a) Escriba la configuración electrónica de los elementos A, B y C, cuyos números atómicos son 33, 35 y 37, respectivamente.
b) Indique el grupo y el periodo al que pertenecen.
c) Razone qué elemento tendrá mayor carácter metálico. 2005-A
2.- Indique:
a) Los subniveles de energía, dados por el número cuántico secundario l, que corresponden al nivel cuántico n = 4.
b) A qué tipo de orbitales corresponden los subniveles anteriores.
c) Si existe algún subnivel de n = 5 con energía menor que algún subnivel de n = 4, diga cuál.2005-A
2.- Dadas las siguientes configuraciones electrónicas externas:
ns1; ns2np1; ns2np6
a) Identifique el grupo del sistema periódico al que corresponde cada una de ellas.
b) Para el caso de n = 4, escriba la configuración electrónica completa del elemento de
cada uno de esos grupos y nómbrelo.2005-A
2.- a) Indique el número de electrones desapareados que hay en los siguientes átomos:
As (Z = 33) Cl (Z = 17) Ar (Z = 18)
b) Indique los grupos de números cuánticos que corresponderán a esos electrones
desapareados.2005-A
2.- a) Razone si para un electrón son posibles las siguientes series de números cuánticos: (0, 0, 0, −1/2); (1, 1, 0, +1/2); (2, 1, −1, +1/2); (3, 2, 1, −1/2).
b) Indique a qué tipo de orbital corresponden los estados anteriores que sean posibles.
c) Indique en cuál de ellos la energía es mayor. 2005-A
3.- Dadas las siguientes especies: Ar, Ca2+ y Cl- .
a) Escriba sus configuraciones electrónicas.
b) Ordénelas, razonando la respuesta, en orden creciente de sus radios.
Números atómicos: Ar = 18; Ca = 20; Cl = 17.2005-B
2.- La configuración electrónica del ion X3+ es 1s22s22p63s23p6.
a) ¿Cuál es el número atómico y el símbolo de X?
b) ¿A qué grupo y periodo pertenece ese elemento?
c) Razone si posee electrones desapareados el elemento X.2006-A
2.- Dadas las configuraciones electrónicas:
A : 1s2 3s1 ; B : 1s22s3 ; C : 1s22s22p63s23p5; D : 1s22s22px22py02pz0
Indique razonadamente:
a) La que no cumple el principio de exclusión de Pauli.
b) La que no cumple el principio de máxima multiplicidad de Hund.
c) La que, siendo permitida, contiene electrones desapareados.2006-B
3.- Razone qué gráfica puede representar:
a) El número de electrones de las especies: Ne, Na+, Mg2+ y Al3+.
b) El radio atómico de los elementos: F, Cl, Br y I.
c) La energía de ionización de: Li, Na, K y Rb.2006-B
2.- a) Escriba la configuración electrónica de los iones Mg2+ (Z=12) y S2- (Z=16).
b) Razone cuál de los dos iones tendrá mayor radio.
c) Justifique cuál de los dos elementos, Mg o S, tendrá mayor energía de ionización.2006-A
2.- a) Escriba la configuración electrónica de los iones: Al3+ (Z = 13) y Cl- (Z = 17).
b) Razone cuál de los dos iones tendrá mayor radio.
c) Razone cuál de los elementos correspondientes tendrá mayor energía de ionización. 2006-A
2.- Dadas las configuraciones electrónicas:
A : ls22s1; B : ls22s3 ; C : ls22s22p63s23p5; D : ls2 2s22px2
2py°2pz° Indique razonadamente:
a) La que no cumple el principio de exclusión de Pauli.
b) La que no cumple el principio de máxima multiplicidad de Hund.
c) La que, siendo permitida, contiene electrones desapareados.
Examen Junio-2006-(B)
2.- Los números atómicos de los elementos A, B, C y D son 2, 11, 17 y 25, respectivamente.
a) Escriba, para cada uno de ellos, la configuración electrónica e indique el número de electrones desapareados.
b) Justifique qué elemento tiene mayor radio.
c) Entre los elementos B y C, razone cuál tiene mayor energía de ionización.
Examen Septiembre 2006-(A)
2.- Dados los conjuntos de números cuánticos: (2,1,2, ½); (3,1,−1, ½); (2,2,1,−½); (3,2,−2, ½)
a) Razone cuáles no son permitidos.
b) Indique en qué tipo de orbital se situaría cada uno de los electrones permitidos. 2007-A
2.- Dadas las especies químicas Ne y O2−, razone la veracidad o falsedad de las siguientes
afirmaciones:
a) Ambas especies poseen el mismo número de electrones.
b) Ambas especies poseen el mismo número de protones.
c) El radio del ion óxido es mayor que el del átomo de neón. 2007-B
2.- La configuración electrónica de la capa de valencia de un elemento A es 3s2p5.
a) Justifique si se trata de un metal o un no metal.
b) Indique, razonadamente, un elemento que posea mayor potencial de ionización que A.
c) Indique, razonadamente, un elemento que posea menor potencial de ionización que A. 2007-B
2.- La configuración electrónica del ion X3− es 1s22s22p63s23p6.
a) ¿Cuál es el número atómico y el símbolo de X?
b) ¿A qué grupo y periodo pertenece ese elemento?
c) Razone si el elemento X posee electrones desapareados. 2007-A
2.- Para un átomo de número atómico Z = 50 y número másico A = 126:
a) Indique el número de protones, neutrones y electrones que posee.
b) Escriba su configuración electrónica.
c) Indique el grupo y el periodo al que pertenece el elemento correspondiente. 2007-A
3.- El número de electrones de los elementos A, B, C, D y E es 2, 9, 11, 12 y 13,
respectivamente. Indique, razonando la respuesta, cuál de ellos:
a) Corresponde a un gas noble.
b) Es un metal alcalino.
c) Es el más electronegativo. 2007-B
2.- Para el ión Cl− (Z=17) del isótopo cuyo número másico es 36:
a) Indique el número de protones, electrones y neutrones.
b) Escriba su configuración electrónica.
c) Indique los valores de los números cuánticos de uno de los electrones externos. 2008-B
2.- El número de protones en los núcleos de cinco átomos es el siguiente:
A = 9; B = 16; C = 17; D = 19; E = 20
Razone:
a) ¿Cuál es el más electronegativo?
b) ¿Cuál posee menor energía de ionización?
c) ¿Cuál puede convertirse en anión divalente estable? 2008-A
2.- a) Escriba las configuraciones electrónicas de las especies siguientes: N3– (Z = 7), Mg2+ (Z = 12),
Cl– (Z = 17), K (Z = 19) y Ar (Z = 18).
b) Indique los que son isoelectrónicos.
c) Indique los que presentan electrones desapareados y el número de los mismos. 2008-A
2.- Razone si son verdaderas o falsas las siguientes afirmaciones:
a) El neón y el O2− tienen la misma configuración electrónica.
b) El neón tiene una energía de ionización menor que la del oxígeno.
c) El neón y el O2− tienen el mismo número de protones. 2008-A
3.- Para un elemento de número atómico Z = 20, a partir de su configuración electrónica:
a) Indique el grupo y el periodo al que pertenece y nombre otro elemento del mismo grupo.
b) Justifique la valencia más probable de ese elemento.
c) Indique el valor de los números cuánticos del electrón más externo. 2008-A
2.- Para un átomo en su estado fundamental, razone sobre la veracidad o falsedad de las siguientes afirmaciones:
a) El número máximo de electrones con número cuántico n = 3 es 6.
b) En un orbital 2p sólo puede haber 2 electrones.
c) Si en los orbitales 3d se sitúan 6 electrones, no habrá ninguno desapareado. 2008-A
2.- Considere el elmento cuya configuración electrónica es 1s22s22p63s23p4.
a) ¿ De qué elemento se trata?
b) Justifique el periodo y el grupo del sistema periódico a los que pertenece.
c) ¿Cuál es la configuración de su ion más estable?. 2009-A
2.- El ion positivo de un elemento M tiene de configuración electrónica: M2+:1s22s2p63s2p6d4
a)¿Cuál es el número atómico de M?
b)¿Cuál es la configuración de su ion M3+expresada en función dewl gas noble que la antecede?
c)¿Qué números cuánticos corresponderían a un electrón 3d de este elemento? 2009-A
2.- La siguiente tabla proporciona los valores de las energías de ionización(eV) de tres elementos.
| 1ª | 2ª | 3ª | 4ª |
Li | 5,4 | 75,6 | 122,5 | ----- |
Na | 5,1 | 47,3 | 71,9 | 99,1 |
K | 4,3 | 31,8 | 46,1 | 61,1 |
a) ¿Por qué la primera energía de ionización disminuye del litio al potasio?
b) ¿Por qué la segunda energía de ionización de cada elemento es mucho mayor que la primera?
c) ¿Por qué no se da el valor de la cuarta energía de ionización del litio? 2009-A
3.- Conteste las siguientes cuestiones relativas a un átomo con Z=7 y A= 14;
a) Indique el número de protones, neutrones y electrones.
b) Escriba su configuración electrónica e indique el número de electrones desapareados en su estado fundamental.
c) ¿Cuál es el número máximo de electrones para los que n=2, l=0 y m=0? 2009-B
2.- Considerando las configuraciones electrónicas de las átomos: A (1s22s22p63s1) y B (1s22s22p66p1), razone si las siguientes afirmaciones son verdaderas o falsas:
a) A y B representan elementos distintos.
b) Se necesita energía para pasar de A a B.
c) Se requiere una menor energía papa arrancar un electrón de B que de A. 2009-B
2.- a) Justifique, de las siguientes especies: F-,Ar, y Na+, cuáles son isoelectrónicas.
b) Enuncie el principio de Pauli y ponga un ejemplo.
c) Enuncie el principio de Hund y ponga un ejemplo para su aplicación. 2009-A
0 comentarios